Pozadí a design studie
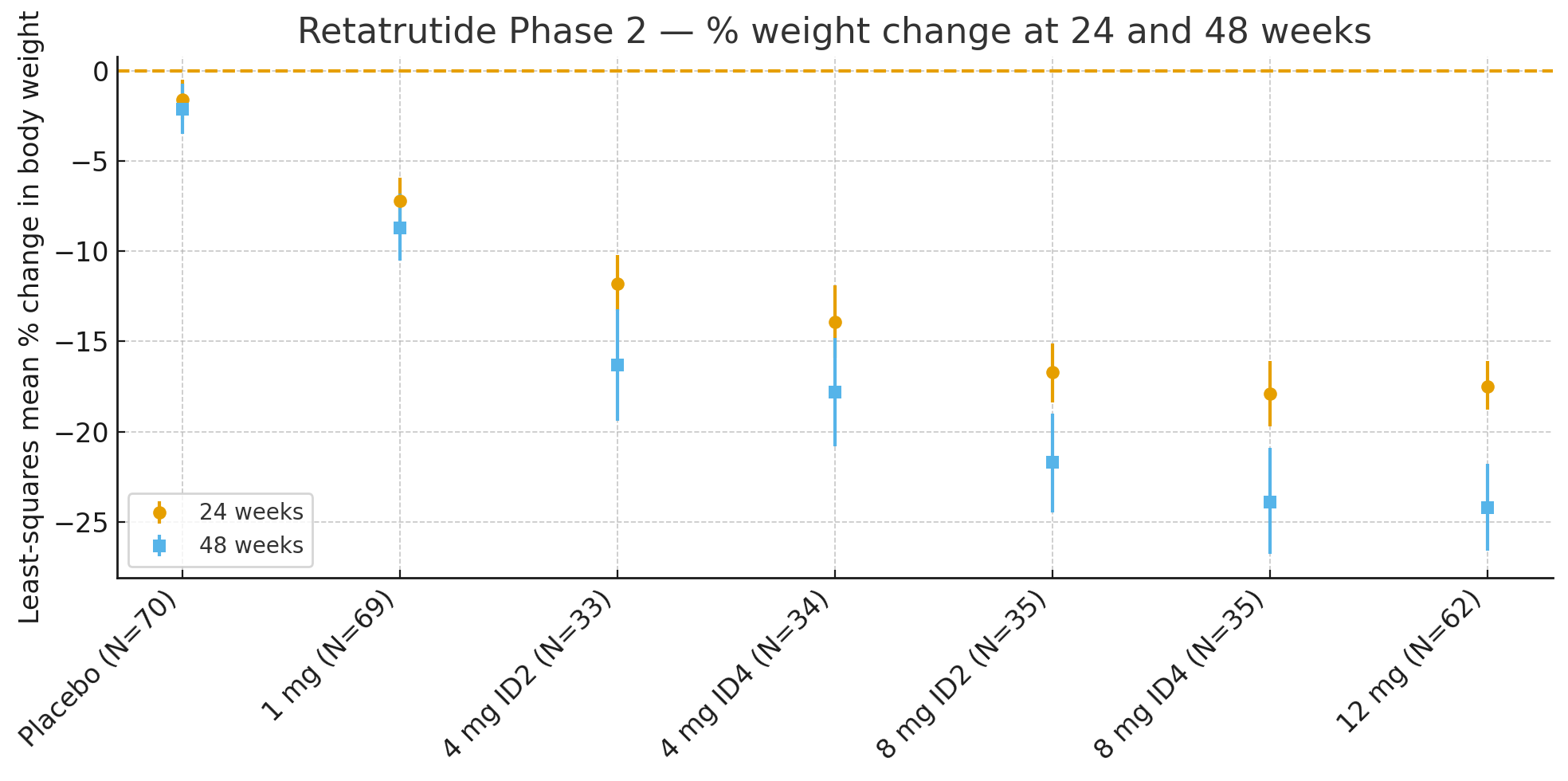
Retatrutid (LY3437943) je nový lék s jedním peptidem, který aktivujetři receptory současně: GIP, GLP-1 a glukagon. Pro vyhodnocení jeho účinnosti a bezpečnosti u jedinců s obezitou, ale bez diabetu, byla provedena randomizovaná, dvojitě zaslepená, placebem kontrolovaná studie fáze 2 (NCT04881760). Celkem338 účastníkůs BMI ≥30 nebo ≥27 s alespoň jednou komorbiditou související s hmotností byli randomizováni k podávání placeba nebo retatrutidu (1 mg, 4 mg se dvěma titračními schématy, 8 mg se dvěma titračními schématy nebo 12 mg) podávaného jednou týdně subkutánní injekcí po dobu 48 týdnů.primární cílový parametrbyla procentuální změna tělesné hmotnosti po 24 týdnech, přičemž sekundární cílové parametry zahrnovaly změnu hmotnosti po 48 týdnech a prahové hodnoty pro úbytek hmotnosti (≥5 %, ≥10 %, ≥15 %).
Klíčové výsledky
-
24 týdnůPrůměrná procentuální změna tělesné hmotnosti vzhledem k výchozímu stavu vypočítaná metodou nejmenších čtverců byla
-
Placebo: −1,6 %
-
1 mg: −7,2 %
-
4 mg (kombinováno): −12,9 %
-
8 mg (kombinováno): −17,3 %
-
12 mg: −17,5 %
-
-
48 týdnůProcentní změna tělesné hmotnosti byla
-
Placebo: −2,1 %
-
1 mg: −8,7 %
-
4 mg (kombinováno): −17,1 %
-
8 mg (kombinováno): −22,8 %
-
12 mg: −24,2 %
-
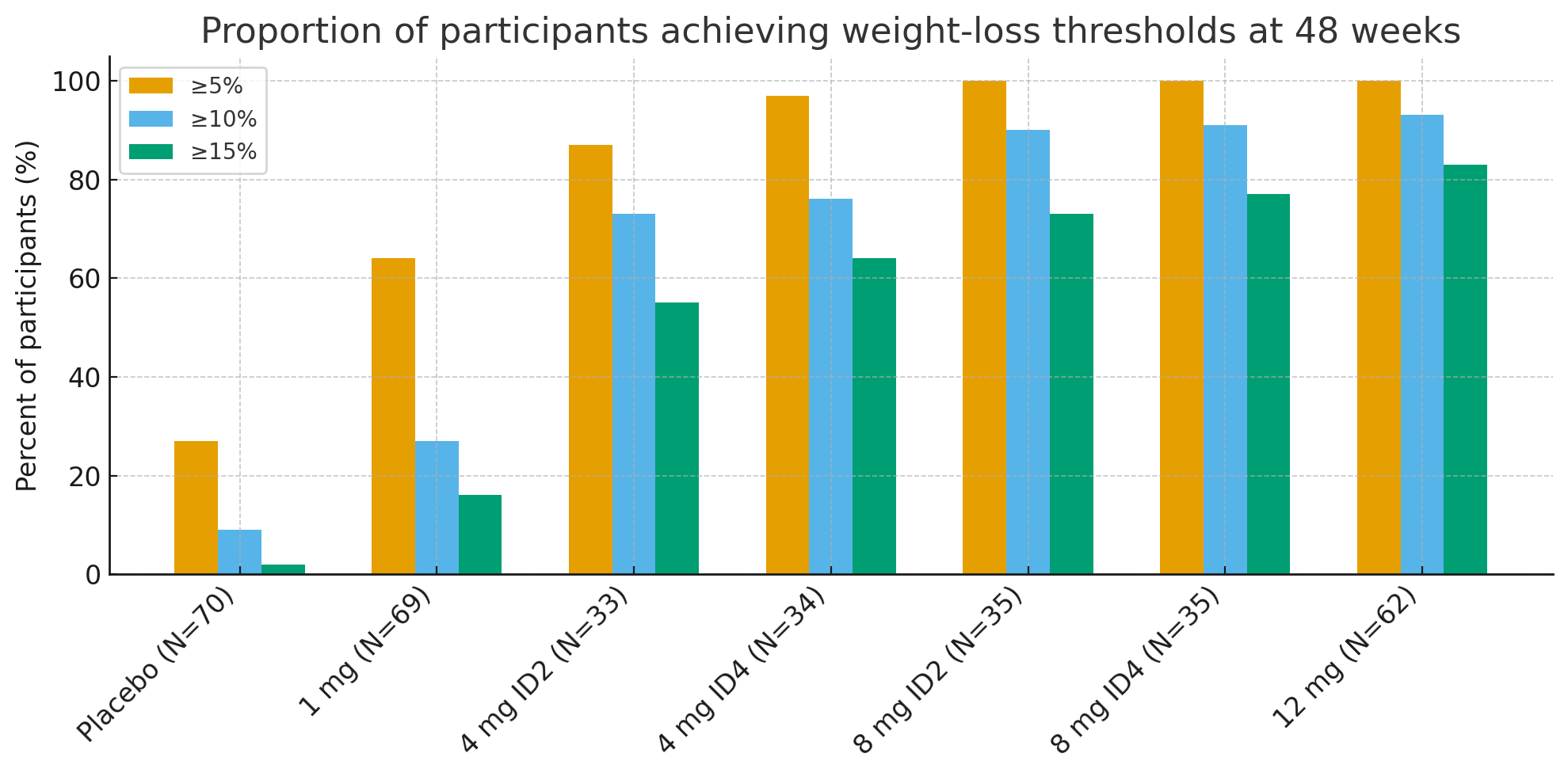
Po 48 týdnech byly podíly účastníků, kteří dosáhli klinicky významných prahů pro úbytek hmotnosti, pozoruhodné:
-
Úbytek hmotnosti ≥5 %: 27 % u placeba vs. 92–100 % v aktivních skupinách
-
≥10 %: 9 % u placeba vs. 73–93 % v aktivních skupinách
-
≥15 %: 2 % u placeba vs. 55–83 % v aktivních skupinách
Ve skupině s 12 mg až26 % účastníků zhublo ≥30 % své výchozí hmotnosti, což je rozsah úbytku hmotnosti srovnatelný s bariatrickou chirurgií.
Bezpečnost
Nejčastějšími nežádoucími účinky byly gastrointestinální (nevolnost, zvracení, průjem), obvykle mírné až středně závažné a závislé na dávce. Nižší počáteční dávky (titrace 2 mg) tyto účinky snížily. Bylo pozorováno zvýšení srdeční frekvence související s dávkou, které vrcholilo ve 24. týdnu a poté klesalo. Míra ukončení léčby se pohybovala v rozmezí 6–16 % napříč aktivními skupinami, což je o něco více než u placeba.
Závěry
U dospělých s obezitou bez diabetu vedl týdenní subkutánní podávání retatrutidu po dobu 48 týdnů kpodstatné, na dávce závislé snížení tělesné hmotnosti(průměrná ztráta až ~24 % při nejvyšší dávce), spolu se zlepšením kardiometabolických markerů. Gastrointestinální nežádoucí účinky byly časté, ale zvládnutelné titrací. Tato zjištění fáze 2 naznačují, že retatrutid by mohl představovat nový terapeutický standard pro obezitu, s očekáváním potvrzení ve větších, dlouhodobých studiích fáze 3.
Čas zveřejnění: 28. září 2025