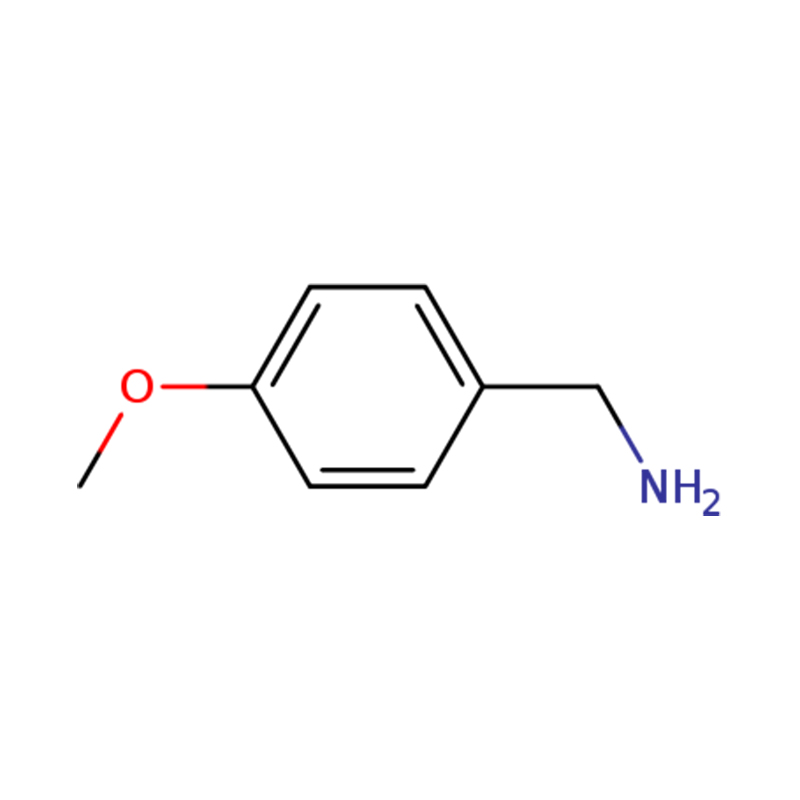
1-(4-METHOXYFENYL)METHANAMIN
Detaily produktu
| Číslo casu | 2393-23-9 | Dodací lhůta | do 10 dnů |
| Molekulární | C8H11NO | Výrobní kapacita | 1 metrická tuna/den |
| Vzhled | Čirá, bezbarvá až slabě nažloutlá tekutina | Čistota | 99 % min. |
| Aplikace | Farmaceutické meziprodukty | Skladování | Pokojová teplota, tma, uzavřené |
| LimitNum | 1 kilogram | Přeprava | Letecká, námořní, expresní doprava. |
| Hustota | 1,05 g/mLat25°C(lit.) | Bod varu | 236–237 °C (osvětleno) |
| Bod tání | -10 °C | Index lomu | n20/D1.546(doslova) |
| Bod vzplanutí: | >230 °F | Rozpustnost | Vysoce rozpustný ve vodě |
| Jméno | p-anisylamin nebo (4-methoxyfenyl)methanamin |
Synonyma
LABOTEST-BB LTBB000703; AKOS BBS-00003589; 4-AMINOMETHYL-ANISOL; 4-METHOXYBENZYLAMIN; P-methoxybenzylamin hydrochlorid 173,64; 4-methoxybenzylamin, 98+ %; pro sparfloxacin; P-METHOXYBENZYLAMIN HYDROCHLORID
Aplikace
Může být použit k syntéze farmaceutických meziproduktů. Je mírně škodlivý pro vodu. Nedovolte, aby se neředěný produkt nebo velké množství produktů dostalo do kontaktu s podzemními vodami, vodními toky nebo kanalizací. Bez povolení úřadu nevypouštějte materiály do okolního prostředí, abyste zabránili kontaktu s oxidy, kyselinami, vzduchem a oxidem uhličitým. Udržujte obal uzavřený, vložte jej do těsně uzavřené nádoby a skladujte na chladném a suchém místě.
Laboratoř kontroly kvality
V areálu se nachází samostatná laboratoř kontroly kvality, kde se provádějí chemické, fyzikální testy, mikrobiální testy, studie stability a přístrojové testy, jako je IR, UV, HPLC a GC, surovin a hotových výrobků. Celý prostor má kontrolovaný přístup a je dobře udržovaný s dostatečným množstvím analytických přístrojů pro zamýšlené účely testování. Všechny přístroje jsou dobře označeny a vhodně kalibrovány.
QA
Oddělení QA je zodpovědné za vyhodnocení a kategorizaci odchylek na závažnou, obecnou a drobnou. U všech úrovní odchylek je nutné provést šetření za účelem identifikace hlavní nebo potenciální příčiny. Šetření musí být dokončeno do 7 pracovních dnů. Po dokončení šetření a identifikaci hlavní příčiny je rovněž vyžadováno posouzení dopadu produktu spolu s plánem CAPA. Odchylka je uzavřena po implementaci CAPA. Všechny odchylky na úrovni by měl schválit manažer QA. Po implementaci je účinnost CAPA potvrzena na základě plánu.